Proprietățile apei: izotopi și structură moleculară.
Proprietățile apei 1: generale
Proprietățile apei 2: proprietăți fizice și chimice
Compoziția izotopică a apei
Apa este un amestec de diverse combinații de izotopi de oxigen și hidrogen care diferă între ei prin numărul de neutroni asociați cu protonii din nucleu.
1H,2 H (Deuteriu)3H (titrit)
16O, 17O,18O.
Raporturile izotopice sunt următoarele:
Pentru hidrogen:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
Tritiul este un element instabil, perioada de înjumătățire a acestuia este de 12,5 ani.
Pentru oxigen:
18O/16O = 1 / 500
17O/16O = 1 / 2500
Principalele specii moleculare 4 și frecvențele acestora sunt următoarele:
1H216O = 99,7%
1H2 18 O = 0,2%
1H217O = 0,04%
1HD16O = 0,03%
D216O = foarte slab
Diferitii izotopi induc diferențe în proprietățile fizice ale moleculelor, în special densitatea acestora, dar proprietățile chimice rămân aceleași.
Apă grea D2O există în starea sa naturală, dar în foarte
scăzut. Pentru a avea o cantitate apreciabilă, este necesar să se stăpânească tehnicile de separare a izotopilor: aceasta a fost una dintre provocările fundamentale din ultimul război mondial pentru a pregăti arma atomică.
Compoziția izotopică a componentelor chimice ale apei este utilizată în estimarea parametrilor termodinamici precum temperatura;
raportul 18 O/16O gheața din calotele polare și apa din apele subterane fosile oferă informații despre clima trecutului.
Evaporarea apei oceanului are loc cu fracționarea izotopică: izotopul ușor al oxigenului se evaporă în locul izotopului greu. Oceanele sunt mai bogate în izotopi grei decât apa din nori și precipitații.
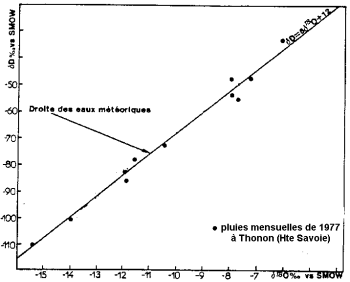
Conținutul de izotop stabil al precipitațiilor (după Blavoux și Letolle, 1995).
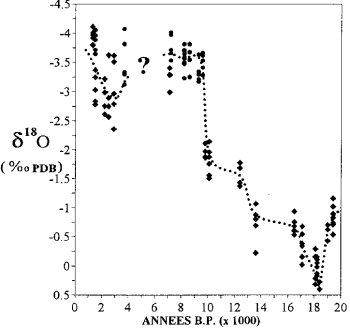
Variația conținutului de izotop de oxigen la corali în Mayotte (după Casanova și colab., 1994).
Structura moleculei
Hidrogenul și atomii de oxigen își unesc electronii pentru a forma un strat complet ca cel al neonului. Într-adevăr, atomului de oxigen îi lipsesc 2 electroni pentru a-și completa carcasa electronică, cei 2 atomi de hidrogen care îl furnizează. Molecula H2O formată este stabilă.
Oxigen: protoni 8 + neutroni 8
Hidrogen: 2 (2 * (proton 1 + neutron 1))
Total: protoni 10 care echilibrează sarcinile electronilor 10.
Nucleii de hidrogen au o parte a oxigenului pentru a forma un „cap Mickey” caracteristic (hidrogenul fiind urechile).
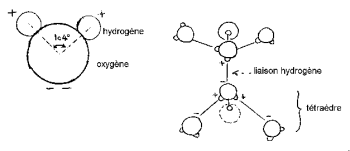
Unghiul HOH este de 104,474 ° (caracteristic geometriei tetraedrice). Distanța dintre atomul de oxigen și hidrogen este aproape de 1 A ° (0,95718 A °) în abur. Diametrul efectiv al moleculei este de ordinul 2,82 A °.
Sarcinile electrice sunt distribuite inegal în această moleculă mică. Electronii sunt mai puternic atrași de atomul de oxigen decât de atomul de hidrogen. Există 2 centre de sarcini pozitive lângă nucleele de hidrogen și 2 centre de sarcini negative în apropierea nucleului de oxigen. Acest dezechilibru în distribuția sarcinilor, combinat cu geometria neliniară a moleculei de apă, se manifestă prin existența unui moment dipol electric puternic. Molecula de apă este polară; se comportă ca un dipol electric care se poate lega astfel cu alte molecule polare. Într-adevăr, moleculele de apă se pot insera între ionii constituenți ai unui cristal direcționând partea lor de sarcină electrică opusă spre ei. Atracția ionilor cristalini este foarte slăbită și coeziunea cristalului este redusă, ceea ce facilitează dizolvarea acestuia. Proprietățile polare ale moleculei de apă explică tehnica încălzirii cu microunde. Într-adevăr, o moleculă polarizată se orientează cu privire la un câmp electric; dacă aceasta variază, molecula urmează schimbarea orientării. De la o anumită frecvență, câțiva GHz pentru apă, mișcările moleculelor produc căldură prin frecare. Cuptoarele de uz casnic funcționează de obicei la o frecvență de 2,45 GHz, care este UHF.
Cei 3 nuclei ai moleculei nu sunt staționari, se mișcă unul față de celălalt, molecula vibrează și se răsucește. În apa lichidă, moleculele tind să se asocieze: capetele lui Mickey leagă urechea de bărbie prin legarea hidrogenului. Într-adevăr, din cei 8 electroni periferici ai oxigenului, doar 4 sunt implicați în legături covalente cu atomii de hidrogen. Restul de 4 electroni sunt grupați în 2 perechi numite dublete de electroni liberi. Fiecare dintre aceste dublete încărcate electric negativ poate forma o legătură electrostatică cu un atom de hidrogen încărcat pozitiv al unei molecule de apă din apropiere. Legătura de hidrogen, care este stabilă la temperatura camerei, este totuși fragilă în comparație cu legătura covalentă. În molecula de apă, geometria formată prin direcția celor 2 legături covalente și a celor 2 dublete electronice libere este apropiată de cea a unui tetraedru al cărui centru este ocupat de nucleele de oxigen.
Cu toate acestea, structura mare a moleculei de apă este încă imperfect cunoscută. Spectrele de difracție cu raze X și neutroni oferă 2 valori principale: un semnal corespunzător 1 A °, distanța dintre nucleele de hidrogen și oxigen și o valoare de 2,84 până la 4 A °, care variază în funcție de temperatură și corespunzător distanței dintre 2 nuclee de oxigen. Difractometria cu raze X face, de asemenea, posibilă cunoașterea numărului mediu de molecule pe unitate de volum de lichid situat la o distanță R de o moleculă dată. O moleculă de apă are în medie 4,4 vecini, ceea ce sugerează o plasă tetraedrică. În plus față de moleculele legate prin legături de hidrogen, există și alte molecule nelegate, ceea ce poate explica de ce numărul moleculelor vecine este puțin mai mare decât 4 și nu 4 exact așa cum ar impune o stare strictă cristalizată tetraedrică. Rețeaua cristalină a moleculelor legate de legături de hidrogen ar forma cavități în care ar fi adăpostite molecule nelegate. O altă ipoteză se bazează pe distorsiunea legăturilor de hidrogen. Acesta din urmă, inițial liniar, adică cu atomii de O - HO aliniați, s-ar putea răsuci în grade diferite și ar permite moleculelor mai îndepărtate decât vecinii apropiați să se apropie de molecula centrală.
Modele teoretice au fost dezvoltate recent folosind computere puternice. Acestea indică faptul că aproximativ 80% din moleculele de apă sunt implicate în 3 sau 4 legături de hidrogen; pe de altă parte, exclud prezența moleculelor nelegate. Modelarea computerizată sugerează că, pe măsură ce apa se răcește, rețelele de molecule seamănă din ce în ce mai mult cu hexagoane similare cu cele din gheață.
Starea solidă corespunde unei aranjamente cristaline mai stricte. La presiune obișnuită, gheața are o structură hexagonală. La temperatură scăzută (sub -80 ° C), poate lua o structură cubică. Sarcinile electrice se pot deplasa în rețeaua cristalină și pot produce defecte cristaline de tip ionic: protonul H3O + hidratat și ionul hidroxil OH-. Rețeaua cristalină de gheață nu corespunde celei mai compacte stivuiri posibile de molecule. La fuziune, defectele se prăbușesc deoarece legăturile de hidrogen se rup și moleculele se apropie: densitatea crește la maxim la 4 ° C. Ulterior, în apa lichidă, creșterea temperaturii împinge moleculele în afară și densitatea scade.
Pentru a afla mai multe, referințe și bibliografie:
Blavoux B. și Letolle R. (1995) - Contribuția tehnicilor izotopice la cunoașterea apelor subterane. Geochronică, 54, p. 12-15.
Caro P. (1990) - Proprietățile fizice și chimice ale apei. Marea carte a apei, La Villette, p. 183-194.
Eagland D. (1990) - Structura apei. La Recherche, 221, p. 548-552.
Maidment DR (1992) - Manual de hidrogeologie. Mc Graw Hill.
Casanova J., Colonna M. și Djerroud K. (1994) - Geoprospective - paleoclimatologie. Rapp. scient. BRGM, p. 76-79.

